생화학 카테고리는 레닌저 생화학책(Lehninger Principles of Biochemistry - David L. Nelson, Michael M.Cox(2017)의 내용을 쭉 소개하는 방식으로 운영하려고 합니다. 일차적인 목표는 12단원까지의 내용을 정리하는 건데, 필자가 이 책을 12단원까지 배웠기 때문입니다. 1단원이 아니라 3단원부터 글을 작성하는 것은... 1단원과 2단원의 내용은 교양 화학과 생물학 수준에 더 가깝기 때문입니다. 지극히 대략적으로 그 내용을 소개해드리면,
Ch 1: 세포의 기본적인 구조, biomolecule을 구성하는 원자(일반적으로 C, H, O, N)와 biomolecule의 종류(탄수화물, 단백질, 지방), 생명체의 몇 가지 화학적 특징(평형과는 멀리 떨어져 있다는 것, 물질과 에너지를 주위와 교환한다는 것, 에너지를 사용하여 orderness를 만든다는 것 등)
Ch 2: 물의 특성 - 수소결합 등 다양한 분자 간 인력, 용액의 총괄성, 산-염기와 용액의 pH
이 정도가 있습니다. 나중에 다른 내용들을 소개할 때 1, 2단원의 내용이 꼭 필요하다고 생각되면 그때 조금 더 설명하도록 하겠습니다.
서론은 이 정도로 하고, 본격적으로 3단원의 내용을 정리해 보겠습니다.
우선 3, 4, 5, 6단원은 모두 단백질에 대한 내용을 다루는데, 그 중 3단원에서는 아미노산, 단백질의 정제, polypeptide의 합성 방법 등을 다루게 됩니다. 단백질의 입체 구조와 기능 같은 부분은 4, 5, 6단원에 나오게 됩니다.
1. 20종류의 아미노산과 그 derivative
단백질은 생명체 안에서 굉장히 중요한 역할을 합니다. 세포 내에서 굉장히 다양한 기능을 하고, 특히 생명체 내에서 반응을 촉진시키는 효소는 대다수가 단백질로 이루어져 있습니다. 그리고 이 단백질의 가장 기본적인 단위체(monomer)를 아미노산(amino acid)이라고 하며, 총 20종류의 아미노산이 있습니다.

아미노산의 기본적인 구조는 위 그림과 같이 C, H, O, N으로 이루어져 잇으며, R 위치에 어떤 작용기가 붙느냐에 따라 아미노산의 종류가 달라지게 됩니다. 그리고 생명체 내의 아미노산은 수용액 상태로, 물에 녹아있기 때문에 왼쪽 구조보다는 오른쪽의 zwitter 구조를 더 많이 가집니다. 수용액의 pH가 7인 경우 COOH보다는 COO-, NH2보다는 NH3+ 형태가 더 안정하기 때문입니다. pH가 달라진다면 저것과 다른 이온화 상태를 가질 수도 있습니다.
추가로 아미노산의 특징을 하나 언급하자면, 아래 그림과 같이 아미노산에 있는 -COOH기의 pKa는 일반적인 -COOH기보다 낮고 -NH3+기의 pKa도 일반적인 -NH3+기보다 낮습니다. 아미노산의 경우 -COOH기에서 H+가 먼저 떨어지고 이후 -NH3+기에서 H+가 떨어지게 되는데, -COOH기에서 proton이 떨어질 때에는 옆에 있는 -NH3+와의 척력에 의해 proton이 한 번 떨어지고 나면 아미노산으로부터 멀어져서 다시 결합하기 어려워집니다. 또 NH3+기는 COO-와 전기적 인력을 형성하여 아미노산의 구조를 안정화시키기도 합니다. Proton이 상대적으로 떨어져나가기 쉬운 환경이기 때문에 pKa가 더 낮아지는 것입니다. 또 아미노산의 carboxyl group에 있는 산소는 전기음성도가 높기 때문에 -NH3+의 전자를 가져오게 되고, 따라서 일반적인 -NH3+보다 아미노산의 -NH3+에서 proton이 더 잘 빠져나오게 되고, pKa가 상대적으로 낮아진다는 특징이 나타납니다.

1) 아미노산 20종류의 구조와 특징
여기서는 아미노산을 특징별로 구분하여 정리하고자 합니다.
(1) nonpolar R groups

먼저 R 자리에 nonpolar한 carbon chain이 붙어있는 경우입니다. 메싸이오닌(methionine)에는 황이 있어서 극성이기는 하나, 극성의 크기가 매우 약하기 때문에 무극성에 가깝다고 분류됩니다. 이런 아미노산들은 모두 물과 친화력이 약하고, 소수성(hydrophobicity)을 갖고 있다는 특징이 있습니다. 그리고 프롤린(proline)은 특이 사항으로 언급할 필요가 있는데, 위 그림에서 보시다시피 -NH2기의 질소가 오각고리 위에 놓여있습니다. 이렇게 아미노산의 기본 구조가 고리 위에 놓이는 아미노산은 프롤린이 유일합니다.
(2) Aromatic R groups

이 아미노산들도 앞선 아미노산들과 마찬가지로 탄소의 수가 많고 극성 작용기의 수가 적어 무극성에 가깝고 hydrophobicity를 갖는다고 할 수 있는데, 차이가 있다면 aromatic ring을 포함하고 있다는 것입니다. 이렇게 aromatic ring을 가지고 있는 아미노산은 굉장히 유용하게 활용될 수 있는데, 그 이유는 이런 아미노산들은 그 양을 쉽게 정량할 수 있기 때문입니다. Aromatic ring을 가질 경우 비교적 긴 파장대(UV나 가시광선)의 빛을 흡수할 수 있고, 이 경우 물질의 농도와 양을 UV-Vis spectroscopy를 이용해 알아낼 수 있습니다. UV-Vis spectroscopy는 가능하다면 따로 소개를 하겠습니다.
(3) Polar, Uncharged R groups

이 아미노산들은 전하를 가지지는 않지만 극성을 띠는 R group을 가진 아미노산입니다. Serine(Ser), threonine(Thr), asparagine(Asn), glutamine(gln)은 모두 수소결합을 할 수 있으며, 수소결합을 통해 단백질의 구조가 변화할 수도 있고, 이런 아미노산이 많이 있는 부위는 친수성을 띠게 됩니다. 또 cysteine(Cys)의 경우 한 단백질 내의 Cys 2개가 서로 -S-S-의 이황화 결합(disulfide bond)를 이룰 수 있는데, 공유 결합으로 상당히 강한 인력에 속하는 이황화 결합은 단백질의 구조에 굉장히 중요한 영향을 끼치는 결합입니다.
(4) Polar, charged R groups

R group은 lysine(Lys), arginine(Arg), histidine(His)처럼 양전하를 가질 수도 있고 aspartate(Asp), glutamate(Glu)처럼 음전하를 가질 수도 있습니다. 이 아미노산들은 pH 7.0을 기준으로 했을 때 위 그림과 같이 양전하 또는 음전하를 갖게 되고, pH가 달라진다면 다른 형태로 존재할 수도 있습니다. 또 pH 7.0에서 양전하를 띠는 아미노산은 basic, 음전하를 띠는 아미노산은 acidic하다고 봅니다. 중성 상태의 분자가 물에 녹으면 lysine, arginine, histidine은 수용액 상에서 H+를 얻고, aspartate, glutamate는 수용액 상에서 H+를 잃어 용액을 각각 염기성, 산성으로 만들기 때문입니다.
2) 아미노산의 몇 가지 derivative
Translation(mRNA의 정보가 번역되어 polypeptide가 합성되는 과정) 이후 몇몇 아미노산은 post-translational modification(번역 이후의 구조 변형)을 통해 구조가 조금씩 변형될 수 있습니다. Post-translational modification에 의해 변형된 아미노산에는 몇몇 작용기가 추가되거나, 당이나 지방이 결합하는 등의 현상이 일어날 수 있습니다. 이렇게 구조가 변화하는 아미노산의 예시와 그 기능을 이 책에서 몇 가지 소개하고 있어서 여기서도 언급을 하려고 합니다.
이 글에서는 4-hydroxyproline, 5-hydroxylysine, 6-N-Methyllysine, γ-carboxyglutamate, selenocysteine 정도를 소개하려고 합니다. 책에 예시가 더 있으니 궁금하신 분들은 한 번 읽어보시면 좋을 것 같습니다.
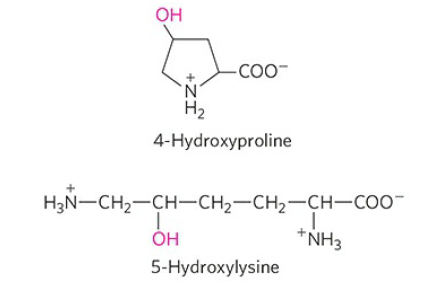
먼저 4-hydroxyproline과 5-hydroxylysine은 각각 proline의 4번 탄소와 lysine의 5번 탄소에 hydroxyl group(-OH기)가 결합한 아미노산입니다. 이 derivative들은 콜라겐을 구성하는 아미노산으로, 추후에 더 자세히 설명드릴 기회가 있을 것입니다.

6-N-methyllysine의 경우 근육의 중요한 구성 물질인 myosin을 구성하는 아미노산입니다. 그리고 γ-carboxyglutamate는 이후에 몇 번 더 언급이 될 derivative인데, 이 derivative는 vitamin K와 큰 관련이 있으며 혈액 응고에서 중요한 역할을 하게 됩니다. 간단히 설명을 드리면 vitamin K는 γ-carboxyglutamate가 합성될 때 반드시 필요한 반응의 cofactor로 작용하며, γ-carboxyglutamate는 혈액 응고를 촉진하는 인자들을 구성하고 있고, 이 인자들에 들어있는 γ-carboxyglutamate는 Ca2+와 결합하여 인자가 활성화가 되고 혈액 응고를 촉진하게 됩니다.

selenocysteine은 cysteine의 황 자리에 황 대신 Se가 결합한 아미노산입니다. 이 아미노산이 포함된 효소는 노화를 일으키는 활성 산소를 제거하는 반응에 관여할 수 있습니다.
2. 단백질의 정제 과정
단백질의 구조를 파악하고 특성과 기능에 대해 알아내기 위해서는 먼저 그 단백질을 생체에서 추출하고, 또 순도가 높게 정제하는 과정이 필요합니다. 이 파트에서는 단백질의 추출 방법과 이를 정제하는 방법 몇 가지를 소개하려고 합니다.
먼저 단백질은 기본적으로 crude extract를 통해 생체에서 추출하게 됩니다. 세포막을 break시켜서 세포를 열면 세포 안의 내용물을 추출할 수 있고, 이 내용물 안에 분석하고자 하는 단백질도 존재합니다. 이 때 원심 분리기를 통해 특정한 크기나 특정한 성질을 가진 부분을 추출해 낸다면 이후 정제 과정에 필요한 수고를 조금 줄일 수 있을 것입니다.
이제 단백질의 정제 과정 몇 가지에 대해 설명드리려고 하는데, 이 책에 나오는 정제 과정으로는 precipitation, ion-exchange chromatography, size-exclusion chromatography, affinity chromatography 등이 있습니다.
1) Precipitation: 수용액에서 특정한 염이 녹아있는 경우 단백질의 용해도가 감소하는 현상이 나타날 수 있습니다. 이렇게 되면 일부 단백질이 precipitation되어서 용액으로부터 분리될 수 있으며, 염의 농도에 따라 단백질의 용해도도 달라지기 때문에 염의 농도를 적절히 조절하여 특정 성질을 가진 단백질을 선택적으로 분리할 수 있습니다. 이 때 염이 단백질의 구조를 변성시켜서는 안 되기 때문에 단백질의 구조에 영향을 잘 끼치지 않는 (NH4)2SO4 (ammonium sulfate)를 염으로 주로 사용합니다. (이 염이 단백질의 구조를 잘 변성시키지 않는다는 것은 실험적으로 확인되었습니다.)
2) 3가지의 chromatography
컬럼 크로마토그래피(column chromatography)는 화학에서 굉장히 중요하게 사용되는 기법으로, 용매(이동상)에 물질을 몇 종류 녹이고 고정상이 채워져 있는 column에 용매를 통과시키면 고정상과의 인력에 따라 물질마다 column을 통과하는 속도가 달라지게 됩니다. 이러한 속도의 차이를 이용해 물질을 분리할 수 있고, 서로 다른 단백질을 분리하여 순도를 높일 때에도 크로마토그래피를 중요하게 활용합니다.
(1) Ion-exchange Chromatography
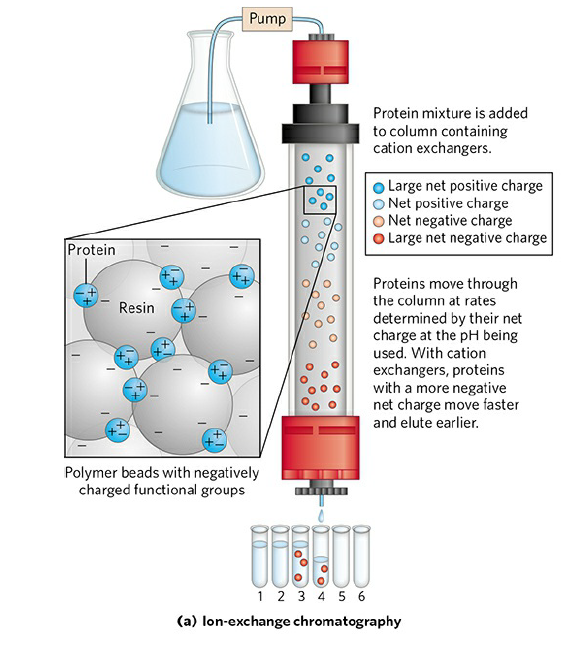
Ion-exchange Chromatography에서는 column에 있는 고정상이 전하를 띠고 있습니다. 이 크로마토그래피는 두 종류로 나눌 수 있는데, 양이온을 띠는 단백질이 늦게 용리(elution)되게 하는 cation-exchange chromatography와 음이온을 띠는 단백질이 늦게 용리되게 하는 anion-exchange chromatography가 있습니다. Cation-exchange chromatography의 경우 고정상을 구성하는 bead에 음이온을 띠는 functional group(ex) -CH2COO-)가 있어 negative net charge를 가진 단백질은 척력에 의해 빠르게 용리되고, positive net charge를 가진 단백질은 bead와 인력을 형성하여 잘 용리되지 않게 됩니다. 반대로 anion-exchange chromatography에서의 bead는 DEAE같은 양전하를 가진 작용기를 갖고 있어 positive net charge를 가진 단백질이 빠르게 용리됩니다. 이와 같은 방법으로 단백질의 전하량 차이를 이용하여 서로 다른 단백질을 분리할 수 있습니다.
(2) Size-exclusion Chromatography

Size-exclusion chromatography는 크기에 따라 물질을 분리하는 기법입니다. 여기서 고정상으로 사용되는 bead에는 pore라고 하는 작은 구멍이 뚫려있는데, 작은 단백질은 이 pore를 통과하면서 이동해야 하므로 상대적으로 느리게 이동하고 크기가 큰 단백질은 pore를 무시하고 column을 통과하기 때문에 보다 빠르게 용리됩니다. 이 때 pore의 크기가 너무 크면 단백질의 크기가 중요한 인자로 작용하지 못하고 대다수의 단백질이 빠르게 용리되어 단백질이 잘 분리되지 못할 수 있기 때문에 작은 크기의 pore를 가진 bead를 사용합니다. 하지만 pore의 크기가 작은 경우에는 단백질이 천천히 용리되고, 단백질의 diffusion에 의한 영향이 커지므로 단백질이 용리될 때 나타나는 peak의 폭이 넓어져서 단백질 사이의 peak이 겹쳐 잘 분리가 되지 못할 수 있기 때문에 용리 속도를 높이기 위한 장치가 필요한데, 위 그림의 pump가 그 역할을 합니다.
(3) Affinity chromatography
Affinity chromatography는 고정상과 단백질 사이의 친화력 차이를 이용하여 단백질을 분리하는 chromatography입니다.

Affinity chromatography에서는 우리가 관심이 있는 단백질과 잘 결합하는 ligand를 bead에 붙여 놓습니다. 그러면 이 ligand와 affinity(친화도)가 높지 않은 다른 단백질들은 빠르게 용리되고, column에는 우리가 관심이 있는 단백질이 ligand와 결합한 상태로 남게 됩니다. 이 때 ligand가 녹아있는 용액을 이 column에 담으면 column에 남아있던 단백질도 용액의 ligand와 결합하여 이동하고, 용리될 수 있습니다.
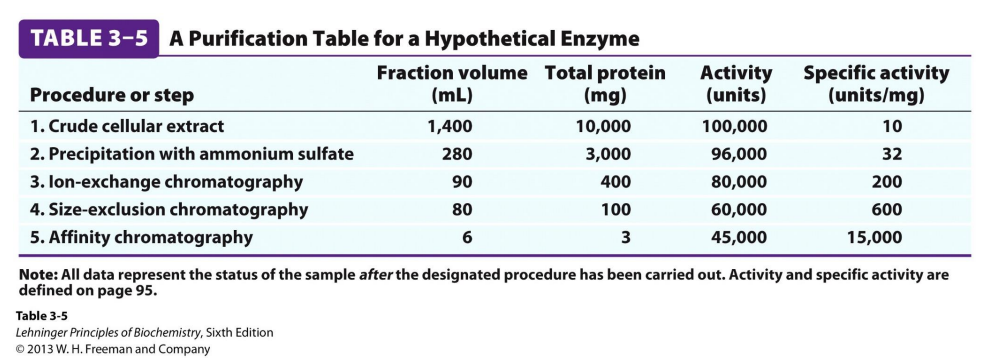
위 표에서 activity라는 것은 효소의 양을 파악하는 수치이고, unit이라는 단위는 섭씨 25도에서 1umol/min만큼의 속도로 기질이 반응하여 생성물이 되기 위해 필요한 효소의 양을 의미합니다. 또 specific activity는 효소의 양을 단백질 sample의 양으로 나눈 값으로 specific activity가 클수록 특정 단백질(효소)의 순도가 높다는 것을 의미합니다. 일반적으로 잘 정제되지 않은 초기 상태의 sample에는 crude extract와 같은 값이 싸고 간단한 기법을 사용해 단백질을 정제하고, 크로마토그래피와 같은 기법은 비교적 후반부에 사용하게 됩니다. 또 위 표와 같이 단백질을 정제할수록 specific activity, 즉 단백질의 순도가 점점 증가한다는 것을 알 수 있습니다.
이 책에서는 추가적으로 단백질의 종류와 sample간 단백질 종류의 개수 차이를 빠르게 파악할 수 있는 방법인electrophoresis(전기 영동)와 단백질의 1차 구조를 파악하는 데에 사용되는 mass spectroscopy에 대한 내용도 나와 있는데, 이 내용들은 가능하다면 다른 글에서 소개드리도록 하고 이제 단백질의 아미노산 서열을 파악하거나 짧은 polypeptide를 합성할 수 있는 유기화학적인 기법을 소개하고자 합니다.
3. 단백질의 아미노산 서열 분석과 polypeptide chain의 합성법
1) 아미노산 서열 분석
아미노산 서열 분석을 위한 유기화학적 기법은 Edman degradation이 있습니다.

위 그림처럼 높은 pH용액에서 polypeptide에 phenylisothiocyanate를 가하여 결합시키고 pH를 낮추면 N-terminal(polypeptide에서 -NH2로 끝나는 부분)에 있는 아미노산 하나가 분리되고 재배열 반응을 통해 맨 오른쪽 구조와 같이 고리 화합물이 만들어집니다. 그리고 이 고리 화합물은 HPLC(크로마토그래피의 일종)를 통해 용리되는 시간을 확인하여 이것이 어떤 아미노산과 결합한 화합물인지 알아낼 수 있습니다. 그리고 이 Edman degradation을 반복하여 polypeptide에 있는 아미노산을 하나씩 알아내면 polypeptide의 아미노산 서열을 알아낼 수 있습니다.
단백질의 아미노산 서열은 짧은 polypeptide chain의 아미노산 서열보다 알아내기가 어렵습니다. 단백질은 아미노산과 아미노산 사이 disulfide bond를 갖고 있어 곧바로 Edman degradation을 수행하기가 어렵고, 또 Edman degradation은 cycle을 많이 돌리면 수율이 급격하게 감소하기 때문에 너무 긴 chain에 대한 아미노산 서열 분석이 어렵습니다. 따라서 Edman degradation 이전에
(a) 산화나 환원 반응을 통한 disulfide bond의 분리(강산을 이용해 산화시키거나 dithiothreitol을 이용해 환원시키면 disulfide bond가 끊깁니다.)
(b) Protease(단백질 분해 효소)를 이용한 단백질의 분해(여기서 단백질은 몇 개의 polypeptide fragment로 분해됩니다.)
(c) HPLC를 통한 각 polypeptide fragment의 purification
의 과정이 필요합니다.
이 과정 이후 각 polypeptide fragment에 대해(이 fragment는 Edman degradation이 가능할 만큼 충분히 짧아야 합니다.) Edman degradation을 수행하고, 이후 fragment가 어떤 순서로 배치되어 단백질을 이루는지 확인해야 합니다. 이 때 한 set의 fragment로는 fragment의 순서를 알아낼 수 없으므로 여러 가지 protease를 사용하여 여러 set의 fragment를 만든 뒤 각 fragment들의 아미노산 서열을 파악하고, 이를 이용해 fragment의 배치 순서를 알아내야 합니다. 아래 그림처럼 퍼즐을 맞추듯이 하면 됩니다.

2) Peptide chain synthesis
마지막으로 peptide를 합성하는 유기화학적 기법에 대해 소개하고 이 글을 마치려고 합니다. Peptide의 합성은 bead를 통한 solid support가 있는 상태에서 Fmoc라는 protecting group(보호기)를 이용하여 이루어집니다. 보호기는 일어나지 않게 하고 싶은 유기 반응이 일어나지 않도록 방지하는 장치라고 할 수 있겠습니다.

Peptide chain의 합성법은 다음과 같습니다.
(a) Fmoc 보호기를 N-terminal에 연결시킨 아미노산의 C-terminal을 solid support에 연결하여 고정시킵니다.
(b) 약한 organic base를 이용하여 Fmoc 보호기를 제거합니다.
(c) solid support에 결합된 아미노산에 연결시키고 싶은 아미노산을 DCC와 반응시킵니다. DCC는 carboxyl group의 반응성을 높여 activation시키는 역할을 합니다.
(d) solid support에 연결된 아미노산의 -NH2기가 activated된 아미노산의 carboxyl group을 attack하여 peptide bond를 형성하면서 결합합니다.
(e) (b)-(d)의 과정을 반복하면 원하는 길이의 peptide chain을 합성할 수 있습니다.
(f) 마지막으로 HF를 이용하면 solid support에서 peptide chain을 분리시켜 우리가 원하는 peptide를 얻을 수 있습니다.
이 때 이 반응의 수율은 cycle의 횟수가 많아질수록 지수함수의 형태로 감소하기 때문에 수율이 충분히 나올 때까지 반응을 진행시켜야 합니다. 따라서 반응을 진행시키는데 시간이 오래 걸리고, 100개의 아미노산으로 이루어진 peptide를 합성하기 위해서는 며칠 동안 같은 작업을 반복해야 합니다. 하지만 bacteria같은 생명체를 이용하면 peptide를 훨씬 더 빠르게 생합성할 수 있는데, 이런 방법은 추후에 더 설명드릴 기회가 있을 것입니다.
3단원은 이 정도에서 마치겠습니다. 4단원에서는 단백질의 2차, 3차, 4차 구조에 대해서 알아보고, 또 단백질이 어떻게 저런 복잡한 구조를 이룰 수 있게 되는지 알아보겠습니다.
'화학 > 생화학' 카테고리의 다른 글
| 레닌저 생화학 Ch. 4 part 2 (0) | 2022.08.10 |
|---|---|
| 레닌저 생화학 Ch. 4 part 1 (0) | 2022.07.27 |
