4단원에서는 단백질이 어떤 3차원 구조를 갖는지, 또 우리가 그 구조를 어떻게 분석할 수 있는지에 대하여 알아보겠습니다. 먼저 단백질의 구조를 분석하는 방법과 단백질이 3차원 구조로 접히는 근거 등에 대해 알아보고 그 다음에 단백질의 2차, 3차, 4차 구조에 대해 차근차근 설명하고자 합니다.
4단원의 목차는
1. Overview
2. 단백질의 2차 구조
3. 단백질의 3차/4차 구조
4. 단백질의 변성과 접힘
으로 구성됩니다. Part 1에서는 overview와 단백질의 2차 구조, part 2에서는 단백질의 3, 4차 구조와 변성, 접힘에 대해 다루려고 합니다.
1. Overview
1) 단백질의 구조를 분석하는 기법
단백질의 구조를 분석하는 방법으로는 크게 X-ray crystallography, NMR, calculation의 3가지가 있고, X-ray crystallography가 가장 유용한 방법으로 알려져 있습니다.
(1) X-ray Crystallography
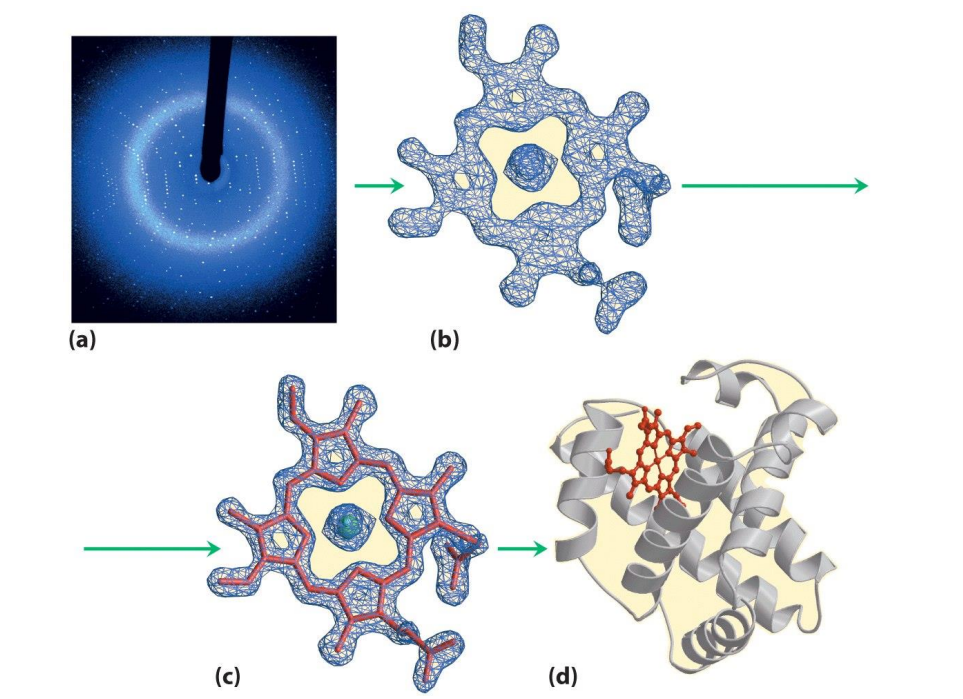
생물학자들은 hanging drop technique을 통해 정제된 단백질 결정을 확보할 수 있고, 얻은 단백질 결정을 X-ray crystallography로 분석할 수 있습니다. 결정에 X선을 쏘면 회절된 X선의 각도와 세기 등의 정보를 이용하여 결정의 3차원 전자 밀도를 알아낼 수 있고, 이를 통해 위 그림처럼 단백질의 3차 구조를 대략적으로 알아낼 수 있습니다. 하지만 이 방법은 결정, 즉 고체 상태의 단백질을 분석한 것이기 때문에 실제 생체 내에서의 구조, 즉 수용액 속 단백질의 3차원 구조와는 다를 수 있다는 한계점도 있습니다.
(2) NMR, calculation
이 방법들은 X-ray crystallography의 단점을 보완하기 위해 추가적으로 활용할 수 있는 분석 방법입니다.
먼저 NMR은 수용액 상태의 단백질도 쉽게 분석할 수 있다는 장점이 있습니다. 이 글에서는 NMR 자체에 대해서 깊이 다루지는 않겠습니다. 유기화학 영역에 더 가까우니까 그 쪽에서 연재하시는 분이 설명을 해주시지 않을까 기대합니다. 그런데 단백질은 굉장히 많은 공유결합을 갖고 있기 때문에 그냥 NMR으로 분석할 경우 의미있는 데이터를 얻기 어렵습니다. 그래서 이 상황에서는 2-dimensional NMR을 활용합니다. 아래 그림처럼요.

분자에 가하는 자기장의 세기와 분자를 들뜨게 하는 interval(간격)을 조절해 가면서 여러 번 NMR을 이용해 측정을 수행하면 위와 같은 2-dimensional NMR peak을 얻을 수 있습니다. 이 때 y=x 근처에 있는 영역에 나타나는 peak은 분자 내 공유결합에 의해 나타나는 peak이고, 그 외 영역에 나타나는 peak은 단백질의 구조적 특성에 의해 나타나는 peak입니다. 즉 위 그림에서 1번, 2번 위치 등에 나타나는 peak을 분석하면 단백질의 특정 부분에 대한 3차원 구조를 어느 정도 파악할 수 있습니다.
다른 방법으로 컴퓨터를 이용해 어떤 단백질의 가장 안정한 상태, 즉 에너지적으로 가장 안정한 상태의 conformation을 calculation을 통해 계산하는 방법도 있습니다. 하지만 polypeptide 내에 있는 아미노산 하나는 약 10개의 conformation을 가질 수 있고, 이에 따르면 단백질은 어마어마하게 많은 conformation을 가질 수 있습니다.(예를 들어 100개의 아미노산으로 이뤄진 단백질은 약 10^100개의 conformation을 가지는 것이죠.) 이것을 모두 계산하기에는 시간이 너무 오래 걸리기 때문에 calculation을 통해 단백질의 구조를 알아내기는 상당히 어렵습니다. 그래도 컴퓨터의 계산, 또는 계산화학은 단백질 등 다양한 화합물의 구조를 분석하기 위해 보조적으로 활용될 수 있는 방법입니다.
다음으로 넘어가기 전에, 막간을 이용해서 2가지 용어를 정리하고 넘어가겠습니다.
conformation: 어떤 분자가 공유결합을 끊지 않고 배열이 변화되면서 이룰 수 있는 여러 가지 분자 구조
native protein: 자연 상태에서 적절하게 접혀서(folded state가 되어) 생체 내에서 기능하는 단백질(denatured protein, 즉 변성된 단백질과는 반의어가 되겠습니다.)
2) 단백질이 unfolded state에서 folded state로 전환되는 근거
단백질이 접히는 과정은 사실 에너지적으로만 보면 큰 이득이 없습니다. 단백질이 분자 내 인력을 형성하면서 접히면 20~65kJ/mol 정도 안정해지는데 이것이 아주 의미있는 수치는 아닙니다. 그럼에도 불구하고 단백질은 굉장히 자발적으로 접혀서 3차원 구조를 이루게 되는데, 이는 단백질이 접히는 과정이 엔트로피적으로 굉장히 유리하기 때문입니다. 접히지 않은 상태의 단백질은 많은 수의 물 분자와 수소 결합을 이루는데, 단백질과 인력을 형성하는 물 분자는 어느 정도 정렬이 되어있기 때문에 엔트로피가 낮은 상태로 존재합니다. 이를 entropy loss라고 합니다. 그런데 단백질이 접히게 되면 표면적이 감소하면서 단백질과 인력을 형성하는 물 분자의 숫자도 감소합니다. 따라서 물 분자들의 entropy loss가 감소하므로 전체적으로 보면 엔트로피가 상당히 많이 증가하게 됩니다.
따라서 단백질이 접히는 과정은 엔탈피적으로 봐도 자발적이긴 하지만, 그것보다는 엔트로피적인 부분에서의 영향이 더 크다는 결론을 얻을 수 있습니다. 일종의 entropy-derived process인 것입니다.
3) Ramachandran plot

위 그림처럼 아미노산 사이에서 만들어지는 peptide bond의 C-N 결합은 단일 결합이라고 볼 수 없습니다. 공명 구조에 의해 partial double bond, 즉 부분적으로 이중 결합을 갖게 되는 것입니다. 이렇게 단일 결합이 아닌 결합은 회전에 있어서 자유롭지 못하고, 회전할 수 있는 각도가 제한되어 있습니다.
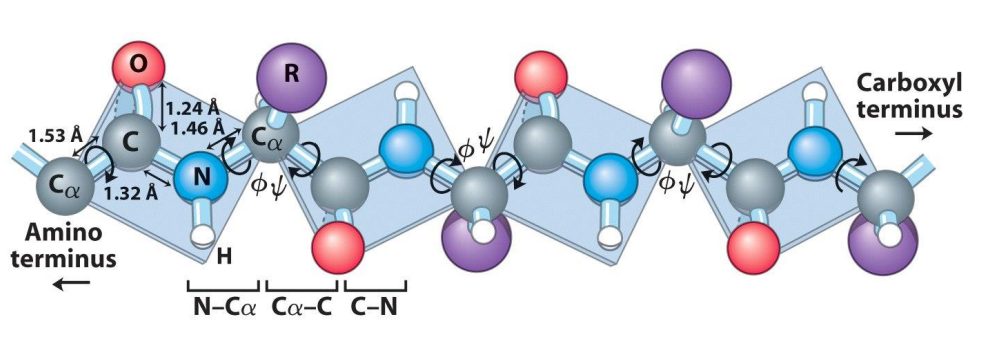
Peptide bond에서 나타나는 C-N partial double bond는 옆에 있는 단일결합들에게도 영향을 주어 회전할 수 있는 각도를 제한합니다. 그리고 이 옆 결합들이 회전할 수 있는 각도의 범위를 나타낸 것이 Ramachandran plot이라고 보시면 되겠습니다.
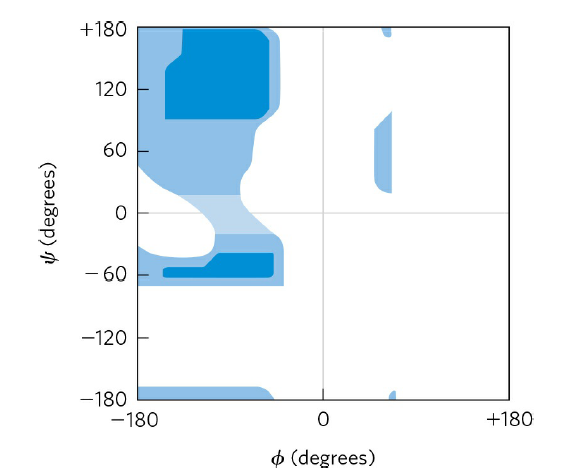
아래 그림이 Ramachandran plot입니다. 여기서 ϕ 결합은 위 그림에서 C-N partial double bond 오른쪽에 있는 N-C 결합이고 ψ 결합은 C-N partial double bond 왼쪽에 있는 C-C 결합을 의미합니다. 아래 그림에서 파란색으로 칠해진 영역은 ϕ, ψ결합이 회전할 수 있는 범위를 의미합니다. 진하게 칠해진 부분은 입체 장애가 거의 없는 상태로 완전히 허용된 회전이라고 할 수 있고, 연하게 칠해진 부분은 입체 장애가 커서 그 상태에서는 거의 회전하지 않는, 즉 flexibility가 낮은 상태의 각도라고 볼 수 있습니다. 이후에도 나오겠지만 이 Ramachandran plot을 이용하여 분석하고자 하는 단백질이 어떤 2차 구조들로 이루어져 있는지 파악할 수 있습니다.
2. 단백질의 2차 구조
이제 본격적으로 단백질의 구조에 대해서 다뤄보겠습니다. 먼저 단백질의 2차 구조로 크게 α-helix(나선형 구조)와 β-sheet(병풍형 구조) 구조가 있다는 것은 많은 분들께서 아실 것이라 생각합니다. 여기서는 어떤 아미노산이 α-helix 구조와 β-sheet 구조를 안정시키거나 불안정하게 만드는지, 그리고 어떤 단백질을 구성하는 α-helix와 β-sheet의 비율은 어떻게 알아낼 수 있는지에 대해서 알아보겠습니다.
1) α-helix 구조

위 그림처럼 α-helix 구조는 3-4개의 아미노산이 배열될 때마다 한 바퀴를 돌며 같은 구조가 반복되면서 여러 개의 아미노산이 나선 형태를 이루게 되는 구조입니다. 그리고 하나의 repeat에 해당하는 길이는 약 5.4Å입니다. 이런 나선 형태의 구조는 아미노산 사이의 수소결합을 통해 다른 conformation보다 상대적으로 안정적인 구조를 이룰 수 있습니다.
이제 이 α-helix 구조의 안정성을 높이는 요인과 낮추는 요인들에 대해 알아보겠습니다. 나선형 구조를 구성하는 아미노산의 배열과 종류에 따라 helix 구조의 안정성이 달라질 수 있고, 그 중 몇 가지에 대해 논의해 보겠습니다.
(a) x번 자리와 (x+1)번 자리, 즉 바로 옆 자리에 같은 부호의 전하로 charge된 아미노산이 배열되면 stability가 낮아집니다. 예를 들면, 바로 옆 위치에 Glu, Asp같이 음전하를 가진 아미노산이 붙어 있거나 Lys, Arg같이 양전하를 가진 아미노산이 붙어 있으면 척력에 의해 구조의 안정성이 낮아집니다.
(b) 크기가 큰, bulky한 R group을 가진 아미노산이 옆에 붙어있으면 입체 장애에 의해 stability가 낮아집니다. Asn, Ser, Thr, Leu처럼 side chain의 크기가 큰 아미노산이 인접해있으면 안정성이 낮아지는 것입니다.
(c) x번 자리와 x+3(4)번 자리, 즉 나선형 구조에서 위아래에 있는 아미노산의 종류가 무엇이냐에 따라서도 안정성이 달라질 수 있습니다. 가령 x번 자리와 x+3(4)번 자리에 서로 반대 부호의 전하로 charge된 아미노산이 배열되면 stability가 높아지고, 또 두 자리 모두에 aromatic ring이 포함된 아미노산이 배치될 경우 base stacking에 의해 더 안정한 구조를 가질 수 있습니다.
(d) Proline이 나선 구조에 존재할 경우 stability가 낮아지는 효과가 나타납니다. Proline의 경우 proline의 질소 원자가 rigid한 ring 위에 있고, 또 이 질소에 수소가 결합되어 있지 않습니다. 따라서 proline의 질소는 수소결합의 형성에 기여하지 못하고, 또 질소 원자와 연관된 결합의 회전이 어려워지므로 나선 구조를 원활하게 이루기 어렵습니다. 그래서 proline은 α-helix 구조의 안정성을 낮추는 대표적인 요인이 됩니다.

(e) 전체 helix의 dipole moment도 helix 구조의 안정성에 영향을 끼칩니다. 기본적으로 위 그림처럼 peptide bond의 dipole moment에 의해 amino group이 존재하는 부분에는 부분적인 양전하가, carboxyl group이 존재하는 쪽에는 부분적인 음전하가 생기게 됩니다. 따라서 amino terminus에 음전하를 띠는 아미노산, carboxyl terminus에 양전하를 띠는 아미노산이 배치되는 경우 정전기적 인력에 의해 helix 구조가 안정화될 수 있습니다.

Propensity에 대해서도 잠시 언급하고 넘어가겠습니다. Propensity라는 것은 alanine과 비교했을 때 아미노산이 α-helical conformation을 이루기 위해 필요한 free energy change를 의미합니다. 따라서 propensity는 어떤 아미노산이 α-helix 구조를 잘 이루는지 파악할 수 있는 정량적인 방법이고, propensity가 클수록 α-helix 구조를 이루기가 더 어렵습니다. 위 표에서 보시다시피 proline의 propensity는 매우 높습니다. α-helix 구조를 형성하는 데에 있어서 proline과 같은 아미노산은 stability를 낮추는 영향을 준다고 볼 수 있습니다.
2) β-sheet 구조
지금까지는 α-helix 구조와 이 구조의 안정성에 영향을 끼치는 요소들을 알아봤습니다. 이제는 또 다른 형태의 대표적인 2차 구조인 β-sheet 구조에 대해 알아볼텐데, 기본적으로 β-sheet 구조는 병풍형이라고 볼 수 있습니다. 이 때 이 병풍형 구조는 완전한 평면은 아니고, 지그재그 형태에 가까운 구조를 가집니다. 그래서 β-sheet 구조를 β-pleated sheet 구조, 즉 주름진 sheet 형태의 구조라고 부르기도 합니다.

위 그림처럼 β-sheet 구조는 parallel할 수도 있고 antiparallel할 수도 있습니다. Antiparallel한 구조에서는 한 chain의 왼쪽이 N terminus이고 오른쪽이 C terminus라면 그 위아래의 chain에서는 오른쪽이 N terminus이고 왼쪽이 C terminus가 되면서 서로 반대 방향으로 chain이 전개됩니다. Parallel한 구조에서는 그 반대로 서로 같은 방향으로 chain이 전개되는 것입니다. 둘 모두 위아래의 chain들끼리 수소결합을 이루면서 stability를 높일 수 있습니다. 특이 사항은 반복되는 최소 단위, 즉 한 repeat의 길이는 parallel 구조가(6.5Å) antiparallel 구조보다(7Å) 짧다는 것입니다.
β-sheet의 끝자락에서는 β-turn이 일어나게 됩니다. 한 chain의 끝에서 다른 chain으로 연결이 되기 위해서는 180도의 회전이 발생해야 하므로 β-turn 구조가 나타나는 것입니다. 이 때 180도 회전을 위해서는 입체 장애를 최소화해야 하므로 β-turn 구조에는 작은 side chain을 가진 아미노산(glycine, alanine 등)이 주로 배치되고, 또 proline이 많이 배치됩니다. Proline이 많이 배치되는 이유는 질소 원자가 고리 위에 존재하기 때문입니다. 이런 특성 때문에 proline은 cis conformation의 비중이 높은 편이고(다른 아미노산들의 경우 trans conformation의 비중이 99.9% 이상, 즉 압도적으로 높지만 proline의 경우 cis conformation의 비중이 6% 정도로, 의미있는 수준으로 높게 나타납니다.) 이런 특성은 β-turn 구조를 안정시킬 수 있기 때문에 proline이 β-turn 구조에 많이 배치됩니다.
3) 2차 구조와 Ramachandran plot, CD spectroscopy
먼저 Ramachandran plot은 단백질의 2차 구조와 깊은 연관성이 있습니다. 앞서 언급한 ϕ, ψ 결합의 각도를 보고 단백질의 2차 구조가 어떤 구조인지 알 수 있는 것입니다. 아래 그림처럼 어떤 2차 구조가 특정한 ϕ, ψ결합 각도의 영역을 갖고 있으면 그 구조가 α-helix인지, β-sheet인지, 아니면 다른 독특한 구조인지 등을 확인할 수 있습니다.

또 absorption spectrum을 이용해 어떤 단백질을 분석하여 α-helix, β-sheet, random coil(α-helix, β-sheet이 아닌 코일 형태의 2차 구조)의 구성비를 알아내는 방법도 있는데, 이를 측정하는 방법을 CD spectroscopy(circular dichroism spectroscopy)라고 합니다.

어떤 단백질의 파장에 따른 circularly polarized light(Δε)를 측정하면 CD spectrum을 얻을 수 있는데, 그 spectrum은 위 그림에서 볼 수 있는 helix, sheet, unstructured part가 가진 spectrum의 조합으로 나타납니다. 저 3가지 spectrum이 어떤 비율으로 조합되었는지 알아내면 단백질의 2차 구조가 어떻게 조성되어 있는지 파악할 수 있으며, 나아가 그 단백질이 올바르게 접힌 상태인지도 확인할 수 있습니다.
이번 글은 여기서 마치고, part 2에서는 단백질의 3, 4차 구조와 변성 등에 대해 알아보겠습니다. 긴 글 읽어주셔서 감사합니다.
'화학 > 생화학' 카테고리의 다른 글
| 레닌저 생화학 Ch. 4 part 2 (0) | 2022.08.10 |
|---|---|
| 레닌저 생화학 Ch.3 (1) | 2022.07.23 |
