3. 단백질의 3차/4차 구조
지금부터는 보다 복잡한 형태의 단백질에 대해 다루려고 합니다. 레닌저 책에서는 3차, 4차 구조의 단백질들을 크게 2가지(Fibrous protein, globular protein)로 분류하고 다루고 있습니다. Fibrous protein은 주로 한 가지의 secondary structure으로만 구성되어 있고 단순한 3차 구조를 가진 protein입니다. 이런 유형의 protein은 몸을 지탱하는 역할을 하거나 추가적으로 생체의 구조를 보호하는 기능을 합니다. 반대로 globular protein은 여러 가지의 secondary structure으로 이루어져 있으며 반응을 제어하는 기능을 하거나 효소의 기능을 하는 단백질입니다.
1) Fibrous Protein
Fibrous protein은 하나의 2차 구조로만 구성되어 있고, α-helix로만 구성되어 있는 protein, β-sheet으로만 구성된 protein, 그리고 독특한 2차 구조로만 구성된 protein 등이 있습니다.
(1) α-helix로만 구성된 protein
먼저 α-helix 2차 구조로만 이루어진 단백질으로는 α-keratin이 있습니다. α-keratin같은 경우 right handed α-helix가 coiled coil 형태로 모여있는 구조로, α-helix가 이황화결합을 통해 모인 coiled coil 구조 여러 개가 모여 filament를 형성합니다. 그리고 이러한 keratin 구조는 상당히 질기고 물에 잘 녹지 않는 구조이며, Ala, Val, Leu, Ile, Met, and Phe과 같은 hydrophobic한 아미노산을 많이 가지고 있습니다. 또 keratin이 모이면 물에 잘 녹지 않는 filament가 형성되고, 즉 이 구조는 머리카락, 동물의 털, 깃털 등을 구성하여 structural protein의 기능을 합니다.
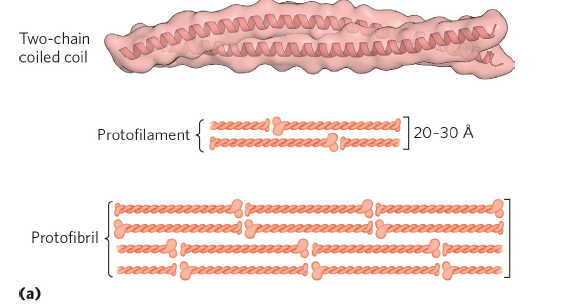
(2) 독특한 구조 - collagen
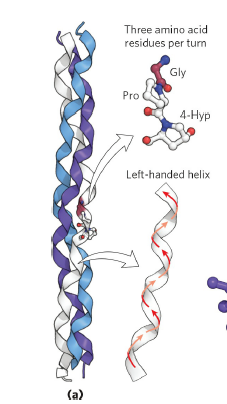
Collagen은 helix 구조를 갖고 있지만, α-helix와는 다른 독특한 구조를 갖고 있습니다. Collagen에서는 3개의 아미노산이 하나의 turn을 구성하고 있으며, left-handed structure이고 helix들은 서로 right-handed 방향으로 꼬여있는 구조를 이룹니다. 이러한 collagen은 장기를 연결하는 조직 등에서 발견되는 경우가 많으며, extracellular matrix를 구성하면서 구조에 strength를 부여하는 역할을 합니다. 즉 collagen이 견고한 상태를 유지하지 못하면 장기와 혈관벽이 약화되어 괴혈병을 일으키게 됩니다.
앞서 3단원에서도 잠깐 언급한 바 있는데, 비타민 C의 결핍이 괴혈병을 일으키는 것은 바로 이 collagen과 연관성이 높습니다. 비타민 C는 proline, lysine과 같은 아미노산에 하이드록시기(-OH기)를 붙이는 hydroxylase를 활성화시키는 역할을 하는데, 비타민 C가 결핍될 경우 이런 hydroxylase가 제대로 기능을 하지 못하여 -OH기가 붙은 아미노산이 합성되지 못합니다. 문제는 이런 아미노산이 collagen을 구성하고 있는 주요 아미노산이라는 점으로, 4-Hyp(4-hydroxyproline)같은 아미노산이 결핍될 경우 collagen이 정상적으로 합성되지 못해 체내 collagen이 부족해지고 괴혈병 증상이 나타나게 됩니다.
이제 collagen의 조성과 collagen이 분자들끼리 이루는 분자간 인력에 대해 알아보겠습니다.
Collagen의 helix 구조는 'Gly(glycine)-X-Y'의 반복으로 구성되어 있습니다. 이때 X나 Y 위치에는 여러 가지 아미노산이 배치될 수 있는데, X 위치에 있는 아미노산 중 1/3에는 proline이 있으며 Y 위치에 있는 아미노산 중 1/3에는 Pro-OH나 Lys-OH가 있습니다.
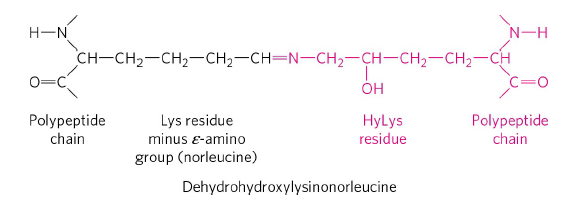
이렇게 형성된 collagen 분자는 아래와 같이 분자끼리 imine bond(그림 중앙의 C=N 이중결합)를 이루면서 complex를 이루고 안정화됩니다. 이때 이 C=N 이중결합을 가진 물질을 schiff base라고도 하며, 생체 내에서 이 결합이 만들어지기 위해서는 lysyloxidase가 필요합니다. Lysyloxidase는 lysine의 -NH2 residue를 산화시켜 aldehyde를 만드는 효소이고, 만들어진 aldehyde는 다른 hydroxylysine의 -NH2 residue와 반응하여 C=N 이중결합, 즉 imine bond가 만들어지게 됩니다.
(3) β-sheet으로만 구성된 protein
이런 protein으로는 silk, 즉 비단이 있습니다.
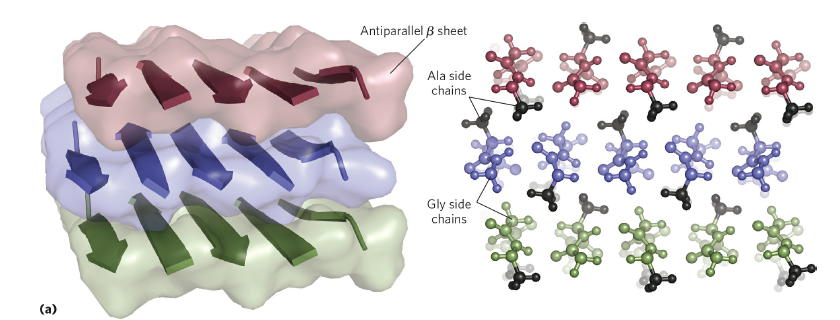
비단은 위 그림과 같이 β-sheet이 층을 이루고 있는 구조를 가지고 있으며, alanine과 glycine을 많이 포함하고 있습니다. 이런 β-sheet 구조들은 disulfide bond를 통해 강하게 연결되어있는 keratin 등과 다르게 약한 분자간 인력을 형성하고 있기 때문에 상대적으로 flexible 하다는 특성을 가지고 있습니다.
2) Globular Protein
아까까지는 생체의 구조를 형성하는 구조 단백질을 다뤘다면, 이제는 생체 내에서 기능을 하는 functional protein, 즉 globular protein에 대해 다루려고 합니다.
(1) Myoglobin과 Heme structure
Myoglobin이나 hemoglobin과 같이 산소를 운반하는 역할을 하는 단백질은 이후 5단원, 즉 단백질의 기능 파트에서 굉장히 자세히 서술되어 있기 때문에 자세한 논의는 5단원에서 하려고 합니다. 여기서는 heme 구조를 위주로 좀 간단히 다루고 넘어가겠습니다.
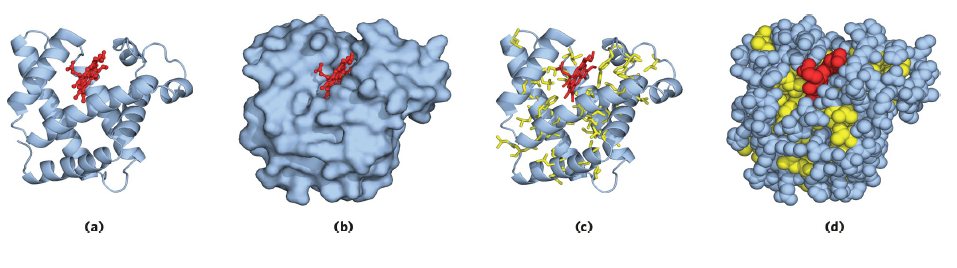
Myoglobin은 α-helix와 β-sheet을 모두 가지고 있는 globular protein의 대표적인 예시이고, 독특한 특성으로 산소와 결합하는 부위인 heme 구조를 갖고 있습니다. Myoglobin은 8개의 α-helix를 갖고 있는데 이들은 모두 right-handed helix이고, hydrophobic한 아미노산은 단백질의 내부에 존재하고 있으며 β-sheet의 β-turn 부위에서는 proline이 관찰되는 것을 확인할 수 있습니다. 전반적인 구조 설명은 이 정도로 하고, myoglobin과 hemoglobin이 갖는 독특한 구조인 heme 구조를 집중적으로 다루고자 합니다.
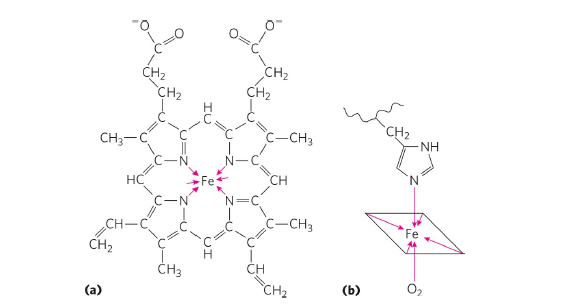
Heme 구조는 Fe, 즉 철 원자를 중심으로 하여 평면으로 형성되는 구조입니다. 철 원자는 위 그림처럼 4개의 오각형 pyrrole 고리에 있는 질소 원자와 배위 결합을 이루고 있으며, 각각의 pyrrole 고리는 methine bridge(고리 사이의 C=C-C 결합)를 통해 다른 pyrrole 고리와 연결되어 있습니다. 또 pyrrole 고리의 끝 부분에는 여러 가지 branch가 결합하고 있는데, 이런 branch로는 -CH3(methyl group), -CH=CH2(vinyl group), -CH2CH2COO-(propionic group)가 있습니다.
이런 heme 구조에는 수직 방향으로 다른 분자가 접근하여 인력을 형성합니다. Myoglobin이나 hemoglobin 단백질에 있는 His residue가 heme 구조의 Fe atom과 수직 방향에서 인력을 형성하며 heme 구조를 안정화시키고, 또 반대쪽에 O2 분자가 결합하게 되면서 myoglobin이나 hemoglobin이 산소와 결합하여 산소를 운반할 수 있게 됩니다.
이 때 myoglobin은 heme 구조를 하나 갖고 있어 한 개의 O2 분자와 결합할 수 있고, hemoglobin은 4개의 subunit을 가지고 4개의 heme 구조를 갖기 때문에 4개의 O2 분자와 결합할 수 있습니다. 이런 구조적 차이에 따라 myoglobin과 hemoglobin 사이에는 기능의 차이가 발생하는데, 이 내용에 대해서는 5단원에서 자세히 설명하겠습니다.
(2) Motif와 Domain, Intrinsically disordered proteins
Globular protein의 3차, 4차 구조는 굉장히 복잡한데, 이를 분석하는 과정에서 몇 가지의 folding pattern이 발견되었습니다. Polypeptide가 접혀서 만들어진 단백질에서 관찰되는 folding pattern으로는 크게 2가지가 있는데, 바로 motif와 domain입니다.
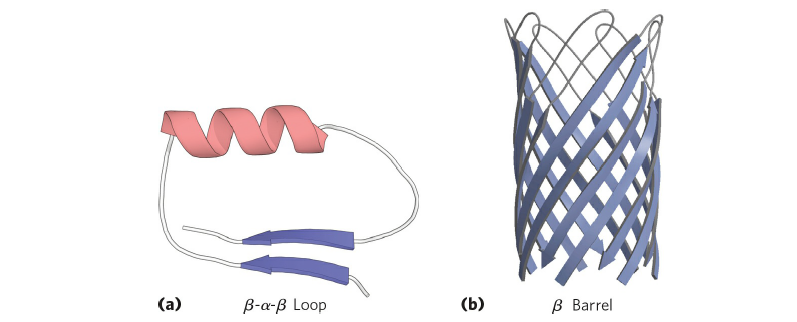
먼저 motif는 fold 혹은 supersecondary structure라고 부르기도 합니다. Supersecondary structure라는 이름에서 알 수 있듯 motif는 2차 구조의 polypeptide가 몇 개 모여서 이루어진 구조로 볼 수 있습니다. 대표적인 예시로 β-α-β loop과 β-barrel이 있으며 구조는 아래 그림과 같습니다. β-α-β loop 같은 경우 DNA의 전사에 관여하는 transcription factor 단백질에 많이 관찰되는 것을 확인할 수 있습니다.
또 다른 중요한 pattern으로는 domain이 있습니다. Domain은 polypeptide가 특정 기능을 하는 최소 단위이고, 상당 수의 단백질은 하나 이상의 domain으로 이루어진다고 볼 수 있습니다. 작은 단백질은 하나의 domain으로 구성되어 domain 자체가 단백질의 역할을 할 수도 있고, 크기가 큰 단백질(수백 개의 아미노산으로 구성된 단백질)은 여러 개의 domain으로 구성되어 여러 가지의 기능을 하거나 단백질 내 domain들이 몇몇 기능들을 분담할 수 있습니다.
Intrinsically disordered protein은 일반적이고, 구조화된 단백질과 달리 조건에 따라 구조가 상대적으로 많이 변할 수 있는 단백질이라고 할 수 있습니다. 이런 단백질들은 서로 다른 여러 단백질들과 상호작용하면서 신호를 전달하는 등의 기능을 주로 수행합니다. Intrinsically disordered protein의 대표적인 예시로는 세포분열을 제어하는 역할을 하는 단백질(tumor supressor protein, 추후에 자세히 설명할 단백질입니다.)인 p53 등이 있습니다.
4. 단백질의 변성과 접힘
1) 단백질의 변성 요인
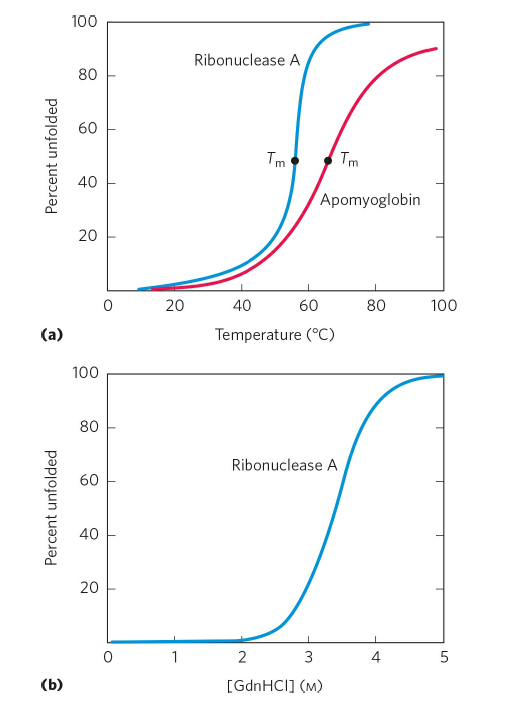
단백질의 변성 요인으로는 다양한 요인이 있는데, 열, pH, 유기용매, 요소, 세제 등이 있습니다. 단백질이 외부 요인에 의해 정상적으로 접힌 상태를 유지하지 못하고 제 기능을 하지 못하는 상태로 변성되는 것입니다. 아래 그림은 온도나 pH에 따라 단백질이 변성되는 비율을 나타낸 그래프입니다. 특정 지점에서 변성된 단백질의 비율이 급격하게 증가하는 것을 관찰할 수 있는데, 이렇게 특정 상태에서 급격히 상태가 변화하는 transition을 abruptness를 가진다고 하며, 또 이런 변화 과정에서는 cooperativity가 존재한다고 생각하고 있습니다. Abruptness와 cooperativity라는 용어는 이후에도(특히 5단원) 자주 언급되므로 이 용어를 잘 기억해주셨으면 합니다.
2) Levinthal's Paradox와 단백질의 접힘 모델
잠시 단백질의 변성이 어떻게 일어난 지 논의했다면, 지금부터는 단백질이 접히는 과정에 대해 조금 더 자세히 얘기해보려고 합니다. 단백질이 접히는 과정은 생체 내에서 약 5초 이내로(아미노산 100개로 구성된 단백질 기준) 굉장히 빠르게 일어납니다. 이렇게 단백질이 빠르게 접히는 과정은 반드시 어떤 메커니즘을 통해 발생해야 하며, 그 근거를 제공하는 것이 바로 Levinthal's paradox입니다.
만약 특별한 메커니즘 없이 단백질이 모든 conformation을 거치면서 가장 안정한 상태의 conformation을 찾는 방식으로 접히게 된다면 어떻게 될까요? 100개의 아미노산을 가진 어떤 단백질을 생각해봅시다. 평균적으로 아미노산 하나는 단백질 내에서 10개 정도의 conformation을 가질 수 있으므로 이 단백질이 가질 수 있는 conformation의 경우의 수는 10^100개 정도가 됩니다. 여기서 단백질이 특정한 conformation으로 존재하는 최소 시간은 10^(-13) 초이므로 단백질이 가장 안정한 상태로 접히는 시간은 10^100 X 10^(-13)(s) X 10^(-10) (yr/s) = 10^77(yr)가 됩니다. 10^77년이라는 무시무시한 결과가 나오는데, 실제 단백질이 접히는 시간과 비교해보면 터무니없는 숫자입니다.
그래서 단백질이 접히는 과정은 특정한 메커니즘에 따라 이루어진다고 과학자들은 보고 있으며, 단백질이 접히는 과정을 몇 가지 모델을 통해 설명하고 있습니다. 단백질의 folding model으로는 diffusion-collision model, framework model, hydrophobic collapse model, molten globule model, jigsaw puzzle model 등 다양한 모델이 있는데 여기서는 hydrophobic collapse model만 소개하고 넘어가겠습니다.
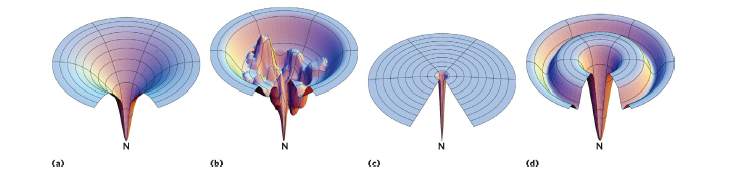
Hydrophobic collapse model은 단백질이 접히는 과정에서 molten globule state를 거치고, energy level이 점점 낮아지는 방향으로 접힌다는 모델입니다. 단백질이 변성되어 접힘이 풀리는 과정에서 구형의 molten globule state를 관찰할 수 있었는데, 과학자들은 반대로 단백질이 접히는 과정에서도 저런 state가 존재할 것이라 보고 이 모델을 만들게 되었습니다. 위 그림의 (a)와 같이 단백질이 다양한 folding pathway를 통해 접히면서 가장 안정한 상태가 되는 넓고 smooth 한 에너지 그래프가 있을 수 있고, (b)와 같이 중간에 local minimum과 maximum이 존재하여 에너지가 가장 낮은 상태가 아닌 다른 상태, 즉 local minimum에 갇힌 state에서 접힘이 멈추고 단백질이 기능할 수도 있습니다.
이처럼 conformation에 따른 단백질의 다양한 energy level 그래프가 존재할 수 있으며, 이에 따라 단백질이 접히는 과정도 다양하게 나타날 수 있습니다.
3) Proteostasis
Proteostasis는 단백질의 항상성을 의미합니다. 생체 내에서는 단백질이 올바른 접힘 구조를 유지해야 합니다. 또 잘못 접혀서 제 기능을 하지 못하고 생체에 악영향을 주는 단백질의 경우 다시 정상적인 상태로 되돌리는 과정이 필요하며, 이런 과정들이 proteostasis에 의해 조절됩니다.
생체 내에서는 다양한 메커니즘을 통해 정상적으로 접히지 않는 단백질을 접히지 않은 상태로 만들어서 다시 올바른 folding state로 만들게 되며, 이 과정에서 에너지를 소모하기 때문에 ATP를 많이 사용하게 됩니다. 한 가지 메커니즘을 소개하면, 아래 그림처럼 GroES, GroEL이 단백질의 refolding(다시 접히는 과정)을 유도하게 됩니다. 이렇게 ATP 등의 에너지원을 소모하여 단백질의 올바른 접힘을 유도하는 구조를 chaperone이라고 부릅니다.
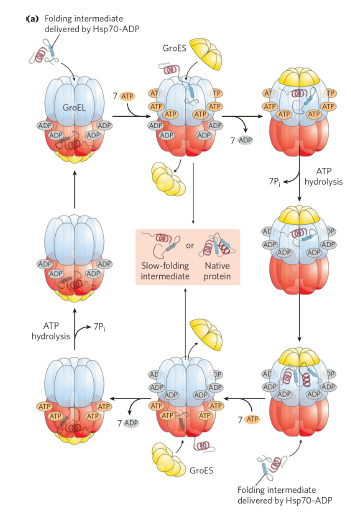
이렇게 단백질이 올바르게 접히도록 유도하는 시스템이 필요한 이유는 올바르게 접히지 않은 단백질이 체내에서 악영향을 일으킬 수 있기 때문입니다. 예를 들면, 아래 그림처럼 잘못 접히거나 일부만 접힌 단백질은 그 단백질끼리 모여서(self-association 또는 self-aggregation) 하나의 aggregate를 형성하게 됩니다. 이런 aggregate는 체내에서 다양한 악영향을 일으킬 수 있는 물질으로 작용하게 됩니다.
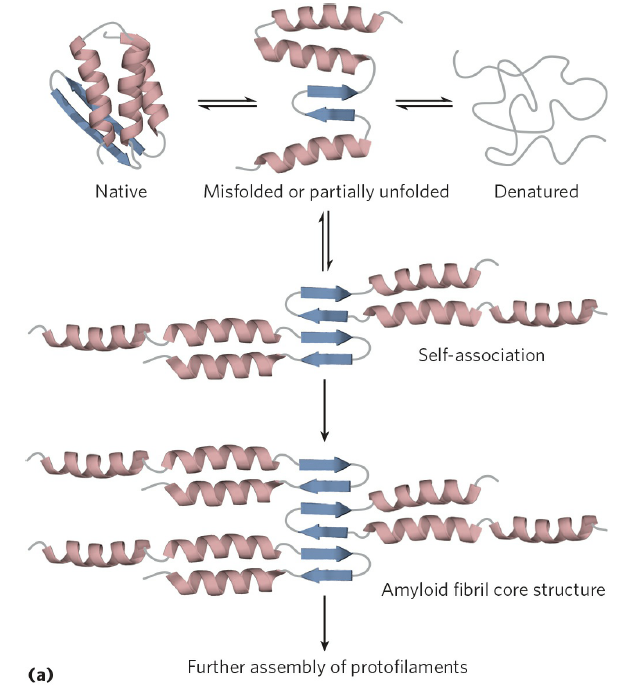
4단원은 여기서 마무리하겠습니다. 5단원은 몇 가지 단백질의 기능을 중점적으로 다루고 있는데, 다음 글에서는 헤모글로빈의 기능을 집중적으로 다뤄보려고 합니다.
'화학 > 생화학' 카테고리의 다른 글
| 레닌저 생화학 Ch. 4 part 1 (0) | 2022.07.27 |
|---|---|
| 레닌저 생화학 Ch.3 (1) | 2022.07.23 |
